Nessun lupo può abbattere un bisonte da solo, ma il branco ha una forza numerica. Una formica sola è una piccola minaccia, ma un'intera colonia è una potente forza distruttiva. Il mondo naturale è ricco di esempi di predatori che cooperano per abbattere le loro prede. E tale lavoro di squadra esiste anche su scala microscopica, anche tra cose che alcuni scienziati non classificherebbero nemmeno come viventi: i virus.
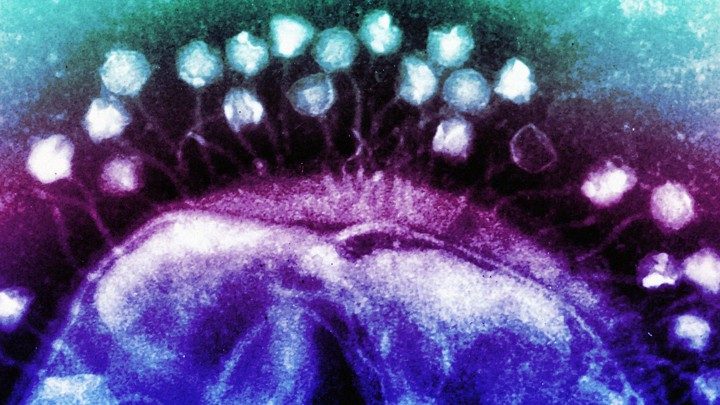
La maggior parte dei virus non infettano l'uomo, ma colpiscono i batteri. Questi virus, conosciuti come fagi [fago, batteriofago], sono come siringhe in miniatura. Prendono il comando dei batteri atterrando su di loro e iniettando il loro materiale genetico al loro interno. Ma i batteri possono difendersi da queste incursioni. Possono memorizzare geni di fago all'interno del loro DNA per costruire un archivio storico dei nemici. Poi usano queste informazioni in memoria temporanea per guidare degli enzimi distruttivi, simili a delle forbici, che cercano i virus corrispondenti e li tagliano.
Questo meccanismo di difesa è conosciuto come CRISPR. E' alla base della tecnica di modificazione genetica che viene utilizzata per curare le malattie umane, controllare le specie invasive, ed ispirare varie trame di film. Ma per miliardi di anni prima che gli scienziati si rendessero conto che le crispr potevano essere usate per alterare il DNA, i batteri le usavano come parte del loro sistema immunitario.
CRISPR è un acronimo che identifica, riferendosi a segmenti di DNA, delle brevi ripetizioni palindrome raggruppate e separate a intervalli regolari. Nel suo insieme, si può intendere anche come un sistema immunitario, visto che le sequenze di DNA, come storico di attacchi subiti dal batterio da parte di virus, costituiscono un sistema di protezione per il batterio stesso. Da qui il riferimento a CRISPR come sia come plurale femminile che singolare maschile nel testo.Il CRISPR non sempre funziona. In 2012, il microbiologo Joseph Bondy-Denomy ha preparato dei fagi per essere usati contro dei batteri portatori di crispr. Alcuni dei virus vennero distrutti, ma altri sopravvissero inaspettatamente ed infettarono il batterio. Bondy-Denomy hanno mostrato che quei fagi sono riusciti a fare affidamento su proteine che potrebbero chiudere le crispr all'interno dei batteri, attaccandosi agli enzimi a forbice inibendoli.
Pertanto, batteri e fagi sono intrappolati in una corsa agli armamenti. I batteri usano crispr per debellare i fagi, e i fagi usano anti-crispr per sovvertire le difese batteriche. L'unico problema è che gli anti-crisprs non dovrebbero funzionare.
E' tutta una questione di tempismo. Una volta che i fagi iniettano i loro geni nelle vittime batteriche, alcuni di questi geni servono come modelli per la produzione di anti-crispr. Questo richiede tempo. Al contrario, i batteri hanno le loro difese crispr già pronte. Questi dovrebbero iniziare immediatamente a distruggere i fagi prima di poter costruire le loro contromisure anti-crispr. Sulla base di questo, "non pensavamo che l'anti-crispr avrebbe funzionato", dice Bondy-Denomy, che ora lavora presso l'Università della California a San Francisco. "Sembrava una corsa contro il tempo".
Il suo collega Adair Borges ha dimostrato che i fagi più lenti possono ancora vincere la gara - fintanto che ce ne siano abbastanza. Il primo attacca il batterio, e viene distrutto da crispr prima che possa produrre abbastanza anti-crispr come contromisura. Tuttavia, per quanti anti-crisprs riesca a produrre rimarrà trattenuto dal batterio, sopprimendo in parte le sue difese immunitarie. Il fago successivo ad invadere il campo può anch'esso venir distrutto, ma ognuno di loro diminuisce le difese del crispr ad ogni nuovo attacco, finché il virus non ha la meglio sulla vittima.
Un secondo gruppo di scienziati, guidato da Stineke van Houte dell'Università di Exeter, ha trovato indipendentemente lo stesso meccanismo. Anche loro hanno dimostrato che gli anti-crispr sono imperfetti e che il loro successo dipende interamente dal numero di fagi presenti. Finché ci sono abbastanza fagi per attaccare successivamente lo stesso batterio, quelli a venire alla fine riusciranno nell'intento anche se i primi falliscono.
Infatti, è solo perché i primi falliscono che contribuisce al successo finale. I primi fagi sono come bombardieri kamikaze, che si lanciano contro le forze nemiche. Si sacrificano, ma danno alla successiva ondata la possibilità di sfondare. "I fagi che seguono traggono beneficio da ciò che il primo si lascia alle spalle", dice van Houte. "È così che cooperano".
Sono pochissimi i microbi che possono infettare con successo un ospite da una singola cellula o particella, dice Britt Koskella da Berkeley, che fa ricerca sui fagi. Le infezioni sono quasi sempre un gioco di numeri. Tuttavia, i fagi sono insoliti in quanto "le infezioni che non hanno avuto successo in precedenza possono aumentare il successo di quelle future", dice. "Questo è l'opposto di quanto accade nella maggior parte degli altri sistemi, dove la precedente esposizione ad agenti patogeni tipicamente innesca il sistema immunitario e diminuisce la probabilità di infezioni future".
Secondo Bondy-Denomy, il comportamento dei fagi somiglia ad una forma di altruismo come per le formiche e le api, in cui gli individui fanno sacrifici per aiutare gli altri che condividono gli stessi geni. Analogamente, nel sacrificare se stessi, i primi fagi aiutano quelli successivi che sono probabilmente identici dal punto di vista genetico. Bondy-Denomy ammette che il termine "altruismo" è un termine carico, e sembra po' eccessivo per dei virus, che chiaramente non esprimono tratti caratteristici di una forma comunitaria, e che sono a cavallo tra il vivente e l'inanimato. "Ma si adatta bene come termine se si accetta che l'altruismo possa essere un processo non neurologico, che non deve venire da decisioni di un membro di una comunità", dice.
Questi studi pongono più domande di quante ne rispondano. Quando le anti-crisprproteine sopprimono il sistema immunitario dei batteri, quanto dura il processo? Se un tipo di fago inizia a indebolire i batteri, un altro tipo potrebbe imbrogliare sfruttando i bersagli immunocompromessi senza fare propri gli anti-crispr? E quanto è importante tutto questo in natura? Dipende da "quanti fagi la cellula batterica media incontra tipicamente", dice Koskella. "Se non è molto alto, allora il sistema crispr dovrebbe essere adeguato nella maggior parte degli ambienti. Ma se i batteri sono costantemente di fronte a una raffica di fagi, allora questo punto di ribaltamento dove i fagi prevalgono sulle difese batteriche potrebbe essere comunemente raggiunto. La risposta è probabilmente da qualche parte in mezzo".
È improbabile che queste battaglie influenzino l'uso di crispr nell'editing genetico, ma "potrebbero avere profonde implicazioni per la fagoterapia", dice Karen Maxwell dell'Università di Toronto. Si tratta di tentativi di usare i fagi per curare le infezioni batteriche negli esseri umani. La fagoterapia è stata a lungo respinta in Occidente come un'idea di strampalata, ma sta godendo di una rinascita dopo i diversi e recenti successi sul trattamento di infezioni batteriologiche resistenti agli antibiotici standard.
Ma, come osserva Maxwell, i numeri contano. "Se vengono somministrati troppi fagi, la terapia fallirà, poiché i fagi saranno portati all'estinzione", dice. Studiando le battaglie tra crispr batterici e fagi anti-crispr, i ricercatori saranno in grado di mettere a punto le dosi di virus necessarie per curare le diverse infezioni.
"Ci sono anche implicazioni per la nostra comprensione delle infezioni virali negli esseri umani", aggiunge Maxwell. Le nostre cellule possono spegnere i geni virali in un modo che è analogo a crispr nei batteri, e molti dei virus che ci infettano ricevono aiuto da proteine che sopprimono queste difese. Queste corse agli armamenti potrebbero aiutare a spiegare perché alcuni virus sono più contagiosi di altri.



I Commenti dei Lettori
alla Newsletter